Inż. zoot. Agnieszka Łoś1, dr n. wet. Bartłomiej Tykałowski2,
dr n. wet. Marcin Śmiałek3,
Uniwersytet Warmińsko-Mazurski w Olsztynie, Wydział Medycyny Weterynaryjnej, ul. Oczapowskiego 13, 10-719 Olsztyn
1Studentka VI roku,
2Katedra Mikrobiologii i Immunologii Klinicznej,
3Katedra Chorób Ptaków
Kokcydioza jest chorobą pasożytniczą wywoływaną u kur przez pierwotniaki z rodzaju Eimeriaspp. Szczególne zagrożenie stanowi u młodych osobników utrzymywanych na ściółce w systemie wielkotowarowym powodując ogromne straty ekonomiczne z tytułu nie tyle upadków, co z zahamowania przyrostów czy problemów z nieśnością w przebiegu subklinicznym.
Pierwotniaki z rodzaju Eimeria wykazują dużą specyficzność względem gatunku żywiciela jak również miejsca bytowania w jego organizmie (Tab. 1). U kur opisano kilka gatunków Eimeriia najważniejsze z nich to: E.acervulina, E. tenella, E.brunetti, E. maxima, E.mitis, E.necatrix,E. praecox.Spośród wymienionych pierwotniaków najbardziej patogenne dla kur są E.tenella, E.necatrix, E.acervulina, E.maxima oraz E.brunetti. Zarówno w stadzie jak i u pojedynczego osobnika mogą wystąpić zarażenia jednym lub kilkoma (najczęściej dwoma czasem trzema i więcej)różnymi gatunkamiEimeriijednocześnie. Dodatkowo w takich momentach do pasożytów dołączają inne patogeny powodującezespoły chorobowe o ciężkim przebiegu zmasowymi upadkami, niezwykle trudne w diagnostyce i terapii.
|
Gatunek |
Lokalizacja zmian |
Zmiany makroskopowe |
|
E. acervulina |
Dwunastnica, jelito biodrowe (podczas ostrej infekcji) |
Białawe, okrągłe zmiany, czasami w formie pasemek; przy silnej inwazji dochodzi do zgrubienia ściany jelita |
|
E.brunetti |
Dystalna część jelita czczego, j. biodrowe, j. końcowe, stek oraz proksymalne części jelit ślepych. |
Zmiany nekrotyczne, śluzowo-krwotoczne zapalenie jelit |
|
E. maxima |
Medialny odcinek jelit- jelito czcze, początek jelita biodrowego, również stwierdzane są zmiany w dwunastnicy |
Zgrubienie ściany jelita, wysięk śluzowaty z krwią, wybroczyny |
|
E. mitis |
Głównie jelito biodrowe i dystalny odcinek j. czczego |
Wysięk śluzowaty |
|
E. necatrix |
Medialny odcinek jelit (schizogonia- jelito czcze i biodrowe; gamogonia- jelita ślepe) |
Rozszerzenie jelita, białe plamy, wybroczyny, wysięk śluzowaty z krwią |
|
E. praecox |
Dwunastnica, proksymalny odcinek j. czczego |
Wysięk śluzowaty |
|
E. tenella |
Jelita ślepe |
Wynaczynienia do światła jelita, zgrubienie ścian, śluz z domieszką krwi w kale |
Tab. 1. Lokalizacja i ogólna charakterystyka zmian powodowanych przez różne gatunki kokcydiów w przebiegu inwazji u kur.
Zarażenie kokcydiami następuje drogą alimentarną. W świetle jelita pod wpływem działania enzymów trawiennych i żółci z oocyst inwazyjnych uwalniane są sporocysty a z nich sporozoity, które penetrują nabłonek jelit. Po wniknięciu do enterocytów sporozoity przekształcają się w trofozoity, które następnie ulegają podziałom tworząc schizonty I rzędu. Schizonty pierwszej generacji przekształcają się w merozoity I rzędu, te wnikają do kolejnych enterocytów przekształcając się tam w schizonty II rzędu. Po kolejnych podziałach z zainfekowanych enterocytów uwalniane są merozoity II rzędu, które ponownie wnikają do kolejnych komórek aby przekształcić się w mikrogametocyty i makrogametocyty (zjawisko gamogonii). Gametocyty dzielą się tworząc mikro- i makrogamety, z których po połączeniu powstaje zygota, a z niej niewysporulowana (nieinwazyjna) oocysta wydalana przez ptaka z kałem do środowiska zewnętrznego ( Ryc. 1). Zarażone ptaki wydalają przez bardzo długi czas oocysty (nawet kilka tygodni), które są bardzo oporne na niesprzyjające warunki i większość stosowanych środków dezynfekcyjnych. W środowisku zewnętrznym przy sprzyjających warunkach (wysoka wilgotność, temperatura, dostępność tlenu) zachodzi sporulacja oocysty. Inwazyjna (wysporulowana)oocysta zawiera cztery sporocysty a w każdej z nich po dwa sporozoity (Ryc. 2).
Ryc. 1. Cykl życiowy Eimeriaspp. (Horvath-Papp, Magazyn Wet, 2010)
Ryc. 2. Oocysta w trakcie sporulacji (Bayer).
Objawy chorobowe nasilają się w trakcie uwalniania się z enterocytów do światła jelita form rozwojowych pierwotniaka. W związku z faktem skomplikowanego cyklu życiowego kokcydiów (występujące liczne formy rozwojowe), objawy kliniczne obserwowane są najczęściej nie wcześniej jak 7 dni po zakażeniu naturalnym. Dochodzi wówczas do uszkodzenia nabłonka jelit, a co za tym idzie do zaburzenia resorpcji składników pokarmowych, zmiany perystaltyki (biegunka/zaparcia), aktywności enzymów trawiennych, zaburzenia składu mikroflory przewodu pokarmowego oraz równowagi wodno-elektrolitowej organizmu. Rozległe uszkodzenia błony śluzowej mogą również manifestować się krwotokami do światła jelita. Ubytki krwi stanowią czasem nawet 7-10 % masy ciała ptaka. U padłych z powodu zarażeniaE. tenella ptaków obserwowano spadek hematokrytu do wartości 14-15 (norma 30-32). Niedobory witamin (A, E, C, K), selenu, obecność mykotoksyn w paszy oraz zakażenia ptaków immunosupresyjnymi wirusami (MDV, IBDV, CIAV, FAdV) dodatkowo zaostrzają przebieg choroby. W następstwie uszkodzenia błony śluzowej przewodu pokarmowego przez pierwotniaki dochodzić może do wtórnych infekcji innymi patogenami w szczególności E. coli czy beztlenowcami z rodzaju Clostridium spp.
Objawy kliniczne jak i przebieg choroby zależą od liczby pobranych oocyst inwazyjnych, gatunku lub gatunkówEimerii i ich patogenności, statusu immunologicznego i wieku ptaków, systemu utrzymania oraz występujących równolegle zakażeń innymi patogenami. U chorych ptaków obserwujemy zazwyczaj apatię, nastroszenie piór, zmniejszony apetyt, biegunkę z domieszką krwi i/lub śluzu, zahamowanie przyrostów a nawet spadek masy ciała.Objawy te różnią się intensywnością występowania w zależności od postaci klinicznej choroby (ostra, przewlekła, podkliniczna).
Występowanie i nasilenie zmian anatomopatologicznych także zależy od liczby gatunków kokcydiów występujących jednocześnie u danego osobnika oraz ewentualnych powikłań np. bakteryjnych.W jelitach pod błoną surowiczą możemy zaobserwować liczne skupiska schizontów pod postacią wydłużonych, poprzecznych białych plamek (Fot. 1), którymmogą towarzyszyć wybroczyny lub te ostatnie występują same. W obrazie sekcyjnym jelita są zazwyczaj balonowato rozdęte a ich błona śluzowa pogrubiona i pokryta otrębiastymi nalotami. Treść jelit może być wodnista, z domieszką krwi, śluzu, odlewów nekrotycznych błony śluzowej. Pod mikroskopem w zeskrobinach z błony śluzowej i skrawkach histologicznych ściany jelit widoczne są stadia rozwojowe kokcydiów oraz nacieki limfocytarne.
Fot. 1. Obecność białych spotów obserwowanych od strony zewnętrznej jelita podczas sekcji padłych z powodu kokcydiozy kurcząt.
W celu prawidłowego rozpoznania kokcydiozy należy przeprowadzić szczegółowe badanie sekcyjne padłych ptaków z określeniem stopnia nasilenia zmian chorobowych (LesionScoring) według skali Johnson’a i Reid’a.Dodatkowo należy wykonać mikroskopowe badania parazytologiczne kału umożliwiającą stwierdzenie obecności oocyst jednego lub kilku gatunków i ich liczby. Do tradycyjnego badania parazytologicznego kału stosujemy metodę flotacji, w której to wykorzystuje się zjawisko wypływania oocyst na powierzchnię płynów o dużym ciężarze właściwym (np. przesycony roztwór NaCl, płyn Darlinga, Fecasol). Dodatkowo przy użyciu komory np. McMastera możemy policzyć oocysty w badanej próbce.Można również wykonać badanie mikroskopowe świeżo pobranych zeskrobinbłony śluzowej zmienionych odcinków jelit. Precyzyjne określenie przynależności gatunkowej w krótkim czasie jest możliwe przy zastosowaniu metod biologii molekularnej np. multiplex PCR. Dzięki tej metodzie możemy w pobranej próbce jednocześnie wykrywać materiał genetyczny pochodzący od kilku gatunków Eimerii. Niestety badania tym sposobem nie są jeszcze popularne w naszym kraju ze względu na ich cenę, która jest dużo wyższa niż tradycyjnego badania parazytologicznego i wymaga specjalistycznego wyposarzenia laboratorium. Alternatywą może być metoda LAMP (Loop-mediatedisothermalamplification- amplifikacja kwasów nukleinowych w warunkach stałej temperatury). Metoda LAMP pozwala na szybką amplifikację dużych ilości DNA z wysoką swoistością oraz czułością. Wynik reakcji widzimy gołym okiem dzięki wykorzystaniubarwnej reakcji podczas interkalowaniamarkerami DNA np. SYBR Green’em lub błękitem hydroksynaftalenowym. Do zastosowania tej metody nie potrzeba drogiego sprzętu, wystarczywirówka oraz łaźnia wodna. Metody te wprowadzono, ponieważ diagnostyka zarażenia określonym gatunkiem kokcydiów na podstawie badanie sekcyjnego jest trudna i opiera się m. in. na stwierdzeniu występowania i lokalizacji charakterystycznych zmian chorobowych w danym odcinkuprzewodu pokarmowego ptaka (właściwie możliwe tylko przy występowaniu jednego gatunku Eimerii). Dodatkowo wykonuje się badanie mikroskopowe pobranych próbek celem określenia morfologii oocyst, stadiów rozwojowych oraz ich wymiarów. Jest to proces pracochłonny, długi i nie zawsze precyzyjny. Z drugiej jednak strony, ostateczna diagnostyka klinicznych przypadków zakażeń Eimeria spp. nie powinna opierać się tylko na wynikach oznaczeń laboratoryjnych. Wynika to z faktu, iż niezależnie od charakteru aplikowanej metody laboratoryjnej (jakościowej czy ilościowej), ostateczny wynik powinien zawsze być konfrontowany z sytuacją kliniczną oraz obrazem sekcyjnym w problematycznym stadzie. Stwierdzenie pojedynczych oocyt w próbkach kału nie musi stanowić wskazania do podjęcia terapii lub rewizji stosowanego programu profilaktycznego, jako że naturalnie występujące infekcje niewielkiego stopnia poprzez stymulację układu immunologicznego zwiększają odporność makroorganizmu na infekcje subkliniczne i kliniczne.
Profilaktyka kokcydiozy oparta jest na stosowaniu kokcydiostatyków w skarmianej paszy (chemioprofilaktyka) i/lub immunoprofilaktyce swoistej (szczepienia ochronne), podawaniu naturalnych preparatów ziołowych a także na rygorystycznym przestrzeganiu zasad bioasekuracji na fermie. Chemioprofilaktyka polega na podawaniu kurczętom rzeźnym kokcydiostatyków przez cały okres odchowu uwzględniając tylko okres karencji przed ubojem. Kurczętom przeznaczonym do reprodukcji i odchowywanym na nioski podaje się kokcydiostatyki przez pierwsze 8-16 tygodni życia. Dostępne na rynku kokcydiostatyki podzielone są na dwie grupy: kokcydiostatykijonoforowe (np.: monenzyna, narazyna,salinomycyna, lazalocid) oraz kokcydiostatyki chemiczne (np.: robenidyna, halofuginon, diclazuril, nikarbazyna). W celu opóźnienia narastania opornośćikokcydiów na kokcydiostatyki należy je stosować wg programu rotacyjnego, gdzie kokcydiostatyk wymieniany jest co 2-3 cykle lub programu wymiennego, w którym stosowane są dwa różne kokcydiostatyki- jeden w mieszance typu starter a drugi (o innym mechanizmie działania) w mieszance typu grower.
Alternatywą bądź uzupełnieniem chemioprofilaktyki jest immunoprofilaktyka swoista. Wśród szczepionek uodporniających przeciwko pierwotniakom z rodzaju Eimeria wyróżniamy szczepionki żywedo podawania per osoparte na szczepach zjadliwych, atenuowanych i opornych na wybrane kokcydiostatyki. Na rynku USA stosowana jest również szczepionka do podawania in ovodzięki zastosowaniu aparatu INOVOJET. Dostępne są także szczepionki podjednostkowe do podawania w iniekcji, które zawierają wyselekcjonowane z makrogametocytów E. maxima immunogenne białka połączone z adiuwantem olejowym. Należy pamiętać, że efektywność szczepionek w dużej mierze zależy od prawidłowego podania preparatu. Natomiast przy wyborze szczepionek o tym, że nie występuje odporność krzyżowa pomiędzy gatunkami kokcydii (wyjątek stanowi szczepionka podjednostkowa, która chroni przed kilkoma gatunkami Eimerii pomimo, że antygen w niej użyty jest wyizolowany z jednego gatunku). Szczepionki powinny być podawane ptakom zdrowym, wprowadzonym do pomieszczeń uprzednio zdezynfekowanych po poprzednim cyklu produkcyjnym z zastosowaniem metod (np. opalanie posadzek) i środków skutecznych przeciwko oocystom.
W leczeniu kokcydiozy stosuje się środki oparte na sulfonamidach bądźtoltrazurilu, jak również preparaty zawierające wyciągi roślinne i olejki eteryczne o udowodnionym działaniu przeciwpierwotniaczym. Te ostatnie lepiej się sprawdzają jednak w profilaktyce niż leczeniu klinicznej kokcydiozy ewentualnie mogą być one stosowane wspomagająco przy leczeniu za pomocą tradycyjnych leków np. do kontynuacji terapii po zaprzestaniu stosowania sulfonamidu czy toltrazurilu.
W stadzie liczącym 122 sztuki, 5-tygodniowych kogutów ogólnoużytkowych utrzymywanych na ściółcestwierdzono pojedyncze upadki jak się następnie okazało spowodowane inwazją E. tenella. Z wywiadu wiadomo, że w profilaktyce kokcydiozy stosowano do 4 tygodnia życia salinomycynę w mieszance starter a następnie zaczęto podawać mieszankę typu grower, tzw. ekologiczną, nie zawierającą kokcydiostatyków. Ptaki nie były również szczepione przeciwko kokcydiozie. Wiadomo również, że na tej samej ściółce były utrzymywane brojlery zakupione (w wieku 3- tygodni) z fermy wielkotowarowej. Jednak brojlery od początku odchowu aż do trzech dni przed ubojem otrzymywały paszę z kokcydiostatykiem (salinomycyną). Po brojlerach kurnik dościelono świeżą słomą i zagazowano przez 2 godziny ozonem (w dwóch cyklach po 60 minut) i pozostawiono (bez ptaków) przez 10 dni, następnie zastosowano bakteriobójcze lampy UV (w dwóch cyklach po 45 minut). Do tak przygotowanego kurnika wprowadzono 1-dniowe kogutki. Pierwsze objawy choroby i upadki zostały zanotowane okołopiątego tygodnia życia ptaków. Stwierdzono wówczas u pojedynczych sztuk apatię (Fot. 2), osowiałość, nastroszenie piór oraz obecność krwi w kałomoczu ( Fot. 3).
Fot.2. Apatia i niechęć do poruszania to pierwsze objawy kokcydiozy.
Fot. 3. Obecność krwi w kałomoczu.
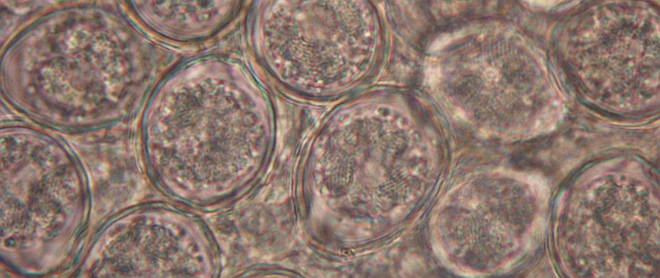
Badaniem sekcyjnym padłych sztuk stwierdzono balonowato rozdęte jelita ślepe z widocznymi, okrągłymi wybroczynami (Fot. 4). Jelita wypełnione były krwistą treścią (Fot. 5). Lokalizacja oraz charakter zmian wskazywały na zarażenie E.tenella. W celu potwierdzenia rozpoznania wstępnego pobrano kał z kilku miejsc kurnika, w którym odchowywane były kogutki, jak również treść jelit ślepych od padłych sztuk do badań mikroskopowych. Próbki kału i treści do badań przygotowano metodą flotacji z zastosowaniem systemu Fecalyzer i płynu Fecasol. W badaniu mikroskopowym stwierdzono bardzo liczne oocystyw polu widzenia (Fot. 6).
Fot. 4. Balonowato rozdęte jelita ślepe z licznymi wybroczynami.
Fot. 5. Jelito ślepe wypełnione krwistą treścią.
Fot. 6. Widoczne pod mikroskopem liczne oocysty w treści jelit slepych.
W związku z zaistniałą sytuacją podjęto decyzję o ponownym wprowadzeniu komercyjnej mieszanki paszowej z kokcydiostatykiem (narazyną) i zastosowaniu w dawce 1g /1l wody ciągłej do picia sulfachloropirazyny sodowej (w preparacie Sulfatyf® ) przez 3 kolejne dni. Wspomagająco podawano z wodą do picia przez okres 5 dni (po terapii Sulfatyfem) preparat ziołowy- Eimerinw dawce zalecanej przez producenta (BioPoint). W trakcie leczenia w stadzie obserwowano jeszcze przez ok 3dni pojedyncze upadki. Badaniem sekcyjnym stwierdzano typowe (książkowe) zmianyanatomopatologicznepowodowane przez E. tenellai dodatkowo włóknikowe zapalenie osierdziawywołane przez E.coli. Po tygodniu od zakończenia leczenia zanotowano nawrót objawów i upadków spowodowanych zarażeniemE. tenella.Tym razem ptaki otrzymały toltrazurilw preparacieBaycox® 2,5% w ilości 1ml/1l wody ciągłej przez okres 2 kolejnych dni a następnie kontynuowano terapię podając z wodą do picia preparat naturalny-AdiCoxSol® (AdiFeed) w dawce 1,5 ml/1l. Następnie po 7 dniowej przerwie ptaki otrzymywały AdiCoxSol® w dawce 1ml/1l wody przez 5 dni.Ściółkę w kurniku przykryto grubą warstwą tektury i pościelono świeżą słomą. Dodatkowo stwierdzono, że najprawdopodobniej występujący w tym stadzie szczep E. tenella jest oporny na narazynę i co bardzo możliwe na salinomycynę, gdyż oba kokcydiostatyki mają zbliżony mechanizm działania i w literaturze jest wiele opisanych przypadków występowania oporności na te substancje u kokcydiów. Rozpoczęto więc skarmianie paszy zawierającej monenzynę w dawce 70 ppm. W dalszych etapach odchowu nie obserwowano problemów z kokcydiozą w opisanym stadzie, co mogło się wiązać z rozwojem odporności swoistej u kogutków, które miały kontakt z pasożytem.
Pismiennictwo do artykułu dostępne u autorów.
Nie jesteś zalogowany. Zaloguj się lub dodaj komentarz bez logowania:
Komentarze (1)
Jeden z niewielu artykułów o tej jednostce chorobowej napisany w przejrzysty i rzeczowy sposób. Nakreśla przyszłość w profilaktyce kokcydiozy. Polecam.